Introducción:
La capacidad de medir muestras con volúmenes de microlitros mediante espectrofotometría UV-Vis ha supuesto una revolución en los laboratorios de biología molecular durante la última década. Sin embargo, al ser una técnica muy sensible, llevar a cabo unas buenas prácticas para preparar y medir las muestras al usar espectrofotómetros de microvolumen evitará errores manuales que afectarían negativamente a la precisión de los resultados y por tanto al análisis posterior de la muestra.
DeNovix Inc. fue creado por los innovadores profesionales originales en el campo de la espectrofotometría de microvolúmenes. Los científicos de DeNovix cuentan con décadas de experiencia en el análisis de absorbancia y fluorescencia. Ellos han elaborado esta guía de mejores prácticas para evitar errores comunes y así garantizar resultados precisos y exactos.
1. La importancia de la preparación de la muestra.
Asegúrese de que llevar a cabo correctamente los protocolos de aislamiento y purificación de muestras antes de la medición. Tenga en cuenta que el UV-Vis no discrimina entre la muestra de interés y los contaminantes que también absorben a la misma longitud de onda. Todos los ácidos nucleicos exhiben un pico de absorbancia alrededor de 260 nm. El ADN degradado o monocatenario contenido en una muestra de ADN bicatenario contribuirá a la absorbancia total a 260 nm, dando como resultado una sobreestimación que será reflejada en el resultado final.
El monitoreo y control de las proporciones de absorbancia medidas proporcionará una idea de la pureza de la muestra e identificará posibles problemas en la preparación de la muestra. Las preparaciones de ADN y ARN puro tienen relaciones A260 / A280 de 1.8 y 2.0 respectivamente y una relación A260 / 230 entre 2 y 2.2. La desviación de estos valores puede indicar contenido de proteína en la primera relación o presencia de carbohidrato, guanidina, fenol o glucógeno para la segunda.
Las relaciones de pureza también pueden verse afectadas cuando se usa una solución inadecuada como blanco o si las muestras están muy diluidas y cerca del límite inferior de detección.
2. Limpieza de la superficie de medida
Asegurarse de que las superficies de medición superior e inferior estén limpias antes de cargar blancos o muestras es crucial para evitar problemas en lecturas posteriores.
Realizar una medición en blanco en una superficie de muestreo sucia (ya sea superior o inferior) dará como resultado valores de absorbancia erróneos, como espectros negativos (Figura 1) o concentraciones de muestra inferiores a los valores reales.
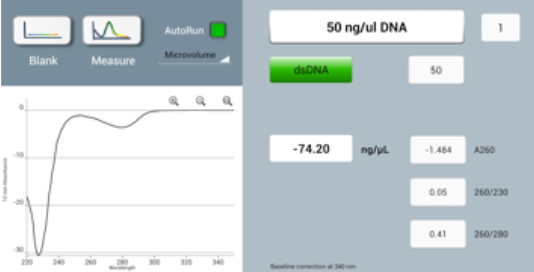
Figura 1: Espectro negativo en un equipo DS-11 obtenido por la realización de un blanco con la superficie de la muestra sucia
Durante un período de uso prolongado, los detergentes o alcoholes presentes en algunos tampones pueden conducir al des-acondicionamiento de la superficie de medición, lo que hace que la muestra quede plana en lugar de acumularse en el pedestal.
Si se observa alguno de los problemas descritos, es importante seguir el protocolo de limpieza recomendado por el fabricante antes de volver a utilizar el equipo.
3. Medidas de los blancos y buffers
Llevar a cabo la medición de un blanco de forma apropiada es un requisito indispensable para mediciones de concentración precisas. Utilice el mismo tampón en el que se suspende la muestra para la lectura en blanco y asegúrese de que las superficies de medición estén limpias antes de la carga. Ver espectros negativos al analizar muestras es un fuerte indicador de que los pedestales de la muestra estaban sucios o que una muestra se midió como un blanco por error.
Al seleccionar buffers, evite aquellos que contienen componentes que absorben fuertemente en la longitud de onda de interés. Por ejemplo, proteínas suspendidas en tampones RIPA, que tienen una alta absorbancia a 280 nm. Cuando se requieren estos tampones, se recomiendan ensayos colorimétricos. El perfil de absorbancia de los tampones puede verificarse con un blanco y con el tampón como muestra.
4. Medida de las muestras dentro de los límites de detección del espectrofotómetro.
Todos los espectrofotómetros tienen un nivel de ruido de fondo aportado por el entorno y los componentes electrónicos. El límite inferior de detección de un instrumento se puede definir como la cantidad más baja de analito que se puede distinguir del ruido de fondo.
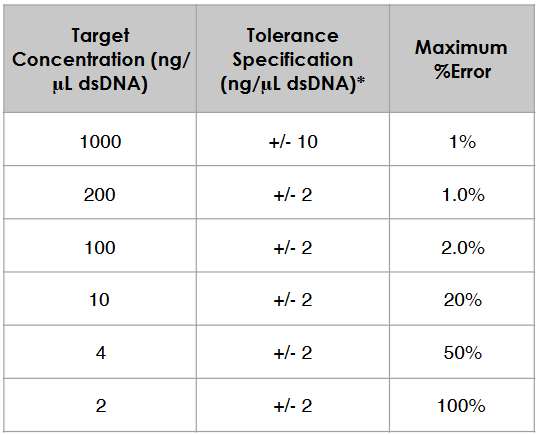
* Las especificaciones de tolerancia indicadas están en un rango típico para espectrofotómetros de microvolumen.
Una especificación de tolerancia puede venir dada como un valor porcentual o como una concentración para un analito específico. Por ejemplo, cuando la especificación de tolerancia es 2 ng / μL para dsDNA, una muestra con una concentración de 4 ng / μL podría variar de 2 a 6 ng / μL debido a la contribución del ruido eléctrico (ver Tabla 1).
Tenga en cuenta que la serie DS-11 tiene un límite de detección inferior líder en la industria para dsDNA de 0.75 ng / μL. Cuando se trabaja con muestras en o cerca del límite de detección inferior, cambiar de microvolumen a usar el modo de cubeta de 1 cm de mayor longitud de trayectoria, como en el espectrofotómetro DS-11 + UV-Vis, incrementa el rango de medición inferior aceptable 20 veces.
5. Rutina de buenas prácticas
- Asegúrese de que las soluciones de muestra sean homogéneas mediante agitación con vórtex antes de la medición.
- Evite introducir burbujas al pipetear las muestras.
- Utilice pipetas calibradas y puntas de ajuste adecuado para garantizar que se dispense 1 μL a la superficie de medición.
- Confirme visualmente que la alícuota ha sido entregada a la superficie de medición. Las muestras de proteínas pueden absorberse hacia el exterior de la punta y puede que no se consigan dispensar adecuadamente.
- Use una punta nueva para cada muestra y siempre use una alícuota nueva para cualquier réplica.
- Use una toallita de laboratorio seca para eliminar la muestra de la superficie superior e inferior inmediatamente después de cada medición.
Resumen
Ser capaz de medir con precisión la absorbancia UV-Vis de muestras en volúmenes de microlitros permite a los investigadores conservar sus materiales preciosos al realizar pasos de control de calidad esenciales para aplicaciones posteriores. La adopción de estos sencillos consejos al cuantificar ácidos nucleicos o proteínas ayudará a brindar precisión y seguridad adicionales en sus mediciones de microvolúmenes.
